
Imaginons un disque d'aire
 placé transversalement au centre du tube, c. à d. à la position de A. Alors, on a
placé transversalement au centre du tube, c. à d. à la position de A. Alors, on a

où <v> est la vitesse moyenne de B, et l'on a supposé une distribution spatiale uniforme de B, de densité  (
( étant le nombre d'Avogadro). Pour tenir compte du mouvement et de la distribution des molécules A, il suffit de
étant le nombre d'Avogadro). Pour tenir compte du mouvement et de la distribution des molécules A, il suffit de
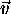 comme étant la vitesse relative de collision
comme étant la vitesse relative de collision
 dans <v> par la masse réduite m
dans <v> par la masse réduite m
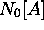 de A
de A
On obtient alors une quantité qui est la fréquence de collisions 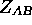 : c'est le nombre de collisions bimoléculaires A-B par seconde et par unité de volume. On a donc
: c'est le nombre de collisions bimoléculaires A-B par seconde et par unité de volume. On a donc
Il est important de se rappeler de l'approximation qui a été faite pour arriver à ce résultat: on a supposé que les deux molécules se comportent comme des sphères dures de rayons 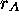 ,
, 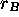 , respectivement. À cause de cette approximation, on appelle cette théorie des collisions bimoléculaires, théorie simple des collisions. Par la nature même du potentiel d'interaction entre les deux molécules tel que proposé par le modèle, ces collisions ne peuvent être qu'élastiques. Des collisions inélastiques ou réactives sont d'office exclues, puisque le modèle ignore la structure interne des deux partenaires, et donc la possibilité que cette structure change.
, respectivement. À cause de cette approximation, on appelle cette théorie des collisions bimoléculaires, théorie simple des collisions. Par la nature même du potentiel d'interaction entre les deux molécules tel que proposé par le modèle, ces collisions ne peuvent être qu'élastiques. Des collisions inélastiques ou réactives sont d'office exclues, puisque le modèle ignore la structure interne des deux partenaires, et donc la possibilité que cette structure change.