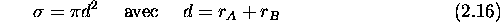
Revenons à la théorie cinétique des gaz parfaits. Une quantité centrale caractérisant la collision entre deux molécules, A et B, a les dimensions d'une aire ou surface. Elle s'appelle section efficace de collision, et dépend des forces intermoléculaires ou encore du potentiel d'interaction entre les deux particules. Dans le cas où ce potentiel est du type 'sphère dure', décrivant la collision entre deux sphères impénétrables de rayon
 et
et 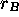 , respectivement, cette section efficace est donnée
par
, respectivement, cette section efficace est donnée
par
d est donc la distance d'approche minimale des deux particules (sphères) A et B, et  est l'aire de la section transversale du tube de collision représenté à la figure 2.4. Ce tube, dont l'orientation est arbitraire et aléatoire, dénote le volume maximal contenant des particules B qui, animées d'une vitesse orientée le long de l'axe du tube, peuvent éventuellement entrer en collision avec la particule A fixée au centre du tube.
est l'aire de la section transversale du tube de collision représenté à la figure 2.4. Ce tube, dont l'orientation est arbitraire et aléatoire, dénote le volume maximal contenant des particules B qui, animées d'une vitesse orientée le long de l'axe du tube, peuvent éventuellement entrer en collision avec la particule A fixée au centre du tube.
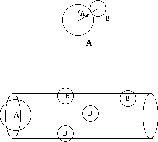
Figure 2.4: tube de collision: c'est le volume maximal contenant des particules B qui, animées d'une vitesse orientée dans une direction donnée (celle de l'axe du tube), peuvent éventuellement entrer en collision avec la particule A. L'aire de la section transversale du tube définit la section efficace de collision A+B.