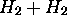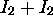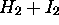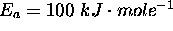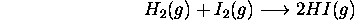
dépend des collisions entre diverses espèces moléculaires présentes dans le mélange réactionnel. Calculez la fréquence de collisions du type
 , à
, à 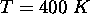 . Utilisez
. Utilisez
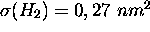 ,
,  .
.
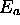 . Quelle est cette proportion pour
. Quelle est cette proportion pour
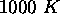 ?
?
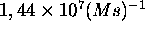 à
à  ,
,  à
à 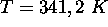 et
et 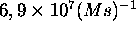 à
à 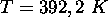 .
.
- Déterminez l'énergie d'activation
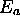 et le facteur pré-exponentiel A pour cette réaction.
et le facteur pré-exponentiel A pour cette réaction.
- En utilisant
 et
et 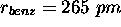 , calculez le facteur stérique P pour cette réaction.
, calculez le facteur stérique P pour cette réaction.
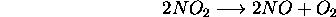
en fonction de la température a conduit aux résultats suivants
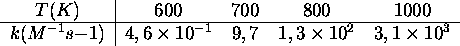
- Déterminez l'énergie d'activation de cette réaction.
- En utilisant
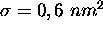 pour la section efficace de collisison, déterminez le facteur stérique P pour cette réaction.
pour la section efficace de collisison, déterminez le facteur stérique P pour cette réaction.

apparait comme l'étape de terminaison de plusieurs réactions en chaîne. Étant donné la grande réactivité du radical méthyle, on peut considérer que cette réaction bimoléculaire se fait avec une énergie d'activation nulle.
- Le diamètre du radical méthyle est
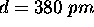 . Estimez la valeur maximale de la constante de vitesse k de la réaction à température ambiante.
. Estimez la valeur maximale de la constante de vitesse k de la réaction à température ambiante.
- La valeur expérimentale de k sous les conditions STP est
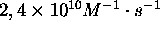 . Estimez le facteur stérique pour cette réaction.
. Estimez le facteur stérique pour cette réaction.