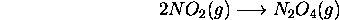. Un piston ajusté au cylindre est déplacé de
. Un piston ajusté au cylindre est déplacé de 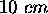 vers l'extérieur quand la réaction est conduite sous une pression maintenue constante à
vers l'extérieur quand la réaction est conduite sous une pression maintenue constante à 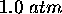 . Calculez le travail effectué par le système réactionnel dans ces conditions.
. Calculez le travail effectué par le système réactionnel dans ces conditions.
 moles d'un gaz monoatomique de
moles d'un gaz monoatomique de 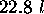 à
à 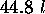 , conduite à
, conduite à 
- de façon réversible,
- contre une presssion externe égale à la pression finale du gaz
- dans le vide
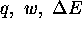 et
et  pour le processus de détente correspondant.
pour le processus de détente correspondant.
 mole d'un gaz parfait, dont
mole d'un gaz parfait, dont 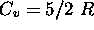 , de façon réversible et à volume constant, pour l'amener d'un état initial spécifié par
, de façon réversible et à volume constant, pour l'amener d'un état initial spécifié par 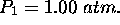 ,
, 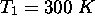 à un état final caractérisé par une température
à un état final caractérisé par une température  . Calculez la pression finale du gaz, la variation
. Calculez la pression finale du gaz, la variation 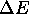 d'énergie interne du gaz, la chaleur q et le travail w impliqué dans ce processus.
d'énergie interne du gaz, la chaleur q et le travail w impliqué dans ce processus.
 de façon réversible à
de façon réversible à 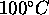 . Sachant que l'enthalpie standard de vaporisation de l'eau vaut
. Sachant que l'enthalpie standard de vaporisation de l'eau vaut  à cette température, calculez
à cette température, calculez  et
et 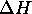 pour ce processus.
pour ce processus.
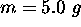 est introduit dans une solution d'acide chlorhydrique diluée que contient un bécher laissé ouvert á l'air libre et maintenu à
est introduit dans une solution d'acide chlorhydrique diluée que contient un bécher laissé ouvert á l'air libre et maintenu à  . Calculez le travail effectué lors de la réaction chimique, (que l'on considérera complète), qui se produit alors.
. Calculez le travail effectué lors de la réaction chimique, (que l'on considérera complète), qui se produit alors.
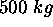 de potassium métallique à
de potassium métallique à 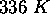 . L'enthalpie de fusion du potassium est
. L'enthalpie de fusion du potassium est 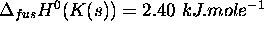 .
.

Calculez  et
et 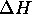 pour le chauffage d'une mole de ce gaz de
pour le chauffage d'une mole de ce gaz de  à
à 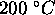 à
à
- pression constante,
- volume constant.
 moles de
moles de  , initialement dans un volume
, initialement dans un volume  à
à 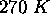 , á une détente adiabatique contre une pression constante de
, á une détente adiabatique contre une pression constante de 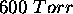 jusqu'à ce qu'il atteigne un volume final
jusqu'à ce qu'il atteigne un volume final  . Calculez
. Calculez  et
et 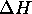 pour ce processus. Quelle serait le pression finale du gaz?
pour ce processus. Quelle serait le pression finale du gaz?
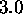 moles d'un gaz parfait initialement à
moles d'un gaz parfait initialement à 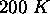 sous une pression de
sous une pression de 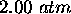 à une compression adiabatique réversible jusqu'à ce qu'il atteigne une température finale de
à une compression adiabatique réversible jusqu'à ce qu'il atteigne une température finale de 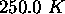 . Étant donné que
. Étant donné que 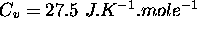 pour ce gaz, calculez
pour ce gaz, calculez 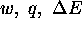 et
et 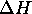 pour ce processus. Calculez la pression et le volume final du gaz.
pour ce processus. Calculez la pression et le volume final du gaz.
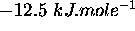 . Calculez son enthalpie standard de combustion.
. Calculez son enthalpie standard de combustion.
 .
.
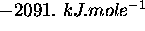 à
à 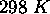 . En utilisant cette donnée, et de celle des enthalpies standards de formation de
. En utilisant cette donnée, et de celle des enthalpies standards de formation de  et
et 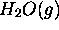 , que l'on peut trouver dans des tables, calculez l'enthalpie standard de formation du cyclopropane. L'enthalpie standard du propène vaut
, que l'on peut trouver dans des tables, calculez l'enthalpie standard de formation du cyclopropane. L'enthalpie standard du propène vaut  . Calculez l'enthalpie standard de la réaction d'isomérisation du cyclopropane en propène.
. Calculez l'enthalpie standard de la réaction d'isomérisation du cyclopropane en propène.
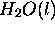 ) de
) de 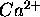 en utilisant les données suivantes:
en utilisant les données suivantes:
- Enthalpie standard de sublimation de
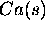 :
: 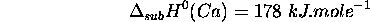
- Enthalpie standard de 1ère ionisation de
 :
: 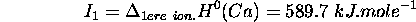
- Enthalpie standard de 2ème ionisation de
 :
: 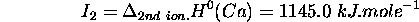
- Enthalpie standard de vaporisation de
 :
: 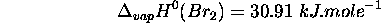
- Enthalpie standard de dissociation de
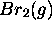 :
: 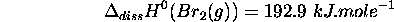
- Affinité électronique de
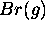 :
: 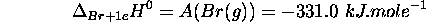
- Enthalpie standard de dissolution de
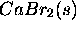 :
: 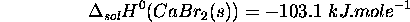
- Enthalpie standard d'hydratation e
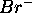 :
: 
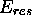 d'un solide cristallin ionique
d'un solide cristallin ionique 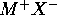 est l'enthalpie standard de la réaction de formation du solide á partir des ions constituants
est l'enthalpie standard de la réaction de formation du solide á partir des ions constituants  considérés en phase gazeuse. À l'aide d'un cycle de Hess, déterminez l'énergie de cohésion
considérés en phase gazeuse. À l'aide d'un cycle de Hess, déterminez l'énergie de cohésion  du NaCl
à partir des données expérimentales suivantes:
du NaCl
à partir des données expérimentales suivantes:
- Enthalpie de sublimation de
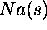 :
:
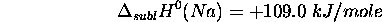
- Enthalpie de formation de
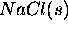 :
:
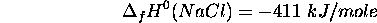
- Enthalpie de dissociation de
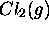 :
:

- Premier potentiel d'ionisation de Na:

- Affinité électronique de Cl:
Note: Dans ce type de calcul d'énergie de cohésion d'un solide ionique, on appelle encore le cycle de Hess, cycle de Born-Haber.
 , on
dispose des données thermodynamiques suivantes:
, on
dispose des données thermodynamiques suivantes:

Calculez l'énergie réticulaire (énergie de cohésion) de AgCl(s) à partir de ces données.
-
En utilisant les valeurs tabulées des enthalpies standard de formation, calculez l'enthalpie standard des réactions suivantes, à
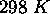 :
:
-
- En utilisant les valeurs tabulées des capacités calorifiques à P constante, recalculez l'enthalpie standard de ces réactions à
 .
.
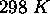 , (b)
, (b) 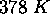 , pour la réaction
, pour la réaction
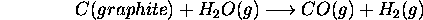
On supposera que la capacité calorifique de toutes les espèces impliquées demeure constante dans cette gamme de température.