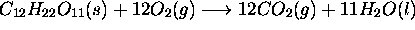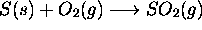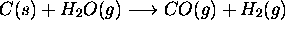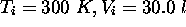 à un état final caractérisé par
à un état final caractérisé par 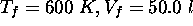 . Calculez la variation d'entropie du gaz au cours de ce processus considéré (a) réversible, (b) irréversible.
. Calculez la variation d'entropie du gaz au cours de ce processus considéré (a) réversible, (b) irréversible.
 , au cours de laquelle il reçoit une quantité de chaleur de
, au cours de laquelle il reçoit une quantité de chaleur de 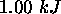 et voit son entropie varier de
et voit son entropie varier de 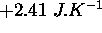 . Ce processus est-il réversible? Détaillez votre raisonnement.
. Ce processus est-il réversible? Détaillez votre raisonnement.
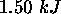 à
à  , et voit son entropie varier de
, et voit son entropie varier de  . Ce processus est-il réversible? Détaillez votre raisonnement.
. Ce processus est-il réversible? Détaillez votre raisonnement.
 , l'un initialement à
, l'un initialement à 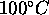 , l'autre à
, l'autre à 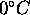 , sont mis en contact l'un avec l'autre à l'intérieur d'une gaine isolante. Étant donné que la capacité calorifique du cuivre vaut
, sont mis en contact l'un avec l'autre à l'intérieur d'une gaine isolante. Étant donné que la capacité calorifique du cuivre vaut 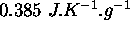 et est constante dans la gamme de température considérée, calculez
et est constante dans la gamme de température considérée, calculez 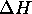 ,
, 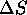 pour le processus qui se produit alors.
pour le processus qui se produit alors.
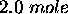 de
de 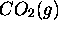 initialement confiné, à
initialement confiné, à  et sous
et sous 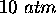 , à l'intérieur d'un cylindre dont la base est d'aire
, à l'intérieur d'un cylindre dont la base est d'aire 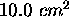 . On le laisse ensuite se détendre de façon adiabatique contre une pression externe de
. On le laisse ensuite se détendre de façon adiabatique contre une pression externe de 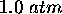 jusqu'à ce que le piston ajusté au cylindre se serait déplacé de
jusqu'à ce que le piston ajusté au cylindre se serait déplacé de 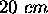 vers l'extérieur. En supposant que
vers l'extérieur. En supposant que 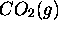 est un gaz parfait avec
est un gaz parfait avec  , calculez
, calculez  et
et 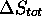 pour ce processus.
pour ce processus.
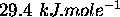 à sa température d'ébullition normale
à sa température d'ébullition normale 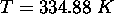 . Calculez
. Calculez
- l'entropie de vaporisaztion du chloroforme à cette température,
- la variation d'entropie de l'environnement et celle de l'univers au cours de la vaporisation du chloroforme à cette température.
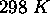 , pour
, pour
 . Comparez les valeurs de
. Comparez les valeurs de 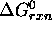 avec celles obtenues à partir des enthalpies libres standards de formations, telles que trouvées dans les tables thermodynamiques.
avec celles obtenues à partir des enthalpies libres standards de formations, telles que trouvées dans les tables thermodynamiques.
 croissant:
croissant:
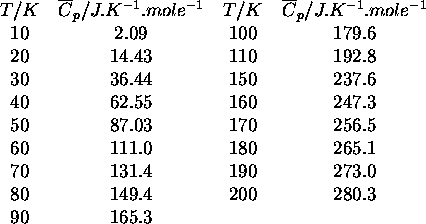
Pour chacune des températures listées, calculez l'enthalpie de ce composé relative à sa valeur au zéro absolu ainsi que son entropie selon la troisième loi. Un programme écrit dans un language informatique quelconque, même en Excel, serait utile pour ce type de problème.
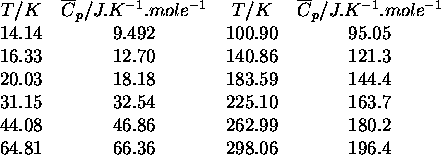
Pour chacune des températures listées, estimez l'enthalpie de ce composé relative à sa valeur au zéro absolu ainsi que son entropie selon la troisième loi.
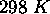 , relatives à leur valeur à
, relatives à leur valeur à  , en utilisant les données suivantes:
, en utilisant les données suivantes:
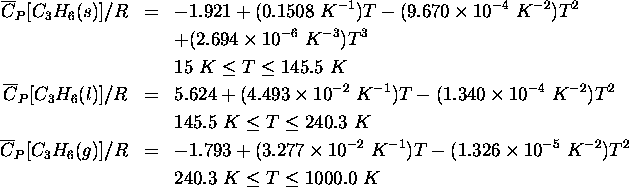
 ,
,  ,
, 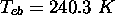 ,
, 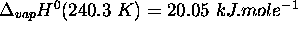 .
.