



Next: Exercices
Up: Thermodynamique: seconde loi
Previous: Troisième loi et
La seconde loi, telle qu'exprimée par eq.(4.11), demande que l'on considère à la fois la variation d'entropie du système et celle de l'environnement. On a vu cependant, eq.(4.38), que cette dernière est reliée à la chaleur impliquée dans le processus réel qui peut être réversible ou irréversible, mais qui, dans les deux cas, peut être vue strictement du point de vue du système. De ce point de vue, cette chaleur serait
- une variation d'énergie interne du système si le processus en est un à volume constant,
- une variation de l'enthalpie du système si le processus est à pression constante.
Ces considérations conduisent à l'introduction de deux nouvelles fonctions d'états, appelés énergies libres, et définies par
- Énergie interne de Helmholtz:

Cette fonction est utile pour décrire des processus isothermes à V constante, pour lesquels

et
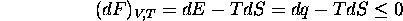
La seconde loi s'exprime donc sous la forme

pour tout processus spontané (ou à l'équilibre) à V et T constantes.
- Énergie interne de Gibbs ou enthalpie libre:

Cette fonction est utile pour décrire des processus isothermes à P constante, pour lesquels

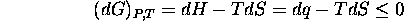
La seconde loi s'exprime donc sous la forme

pour tout processus spontané (ou à l'équilibre) à P et T constantes.
Comme la plupart des réactions chimiques sont conduites à P constante, c'est l'énergie libre de Gibbs, encore appelée enthalpie libre, G, et surtout sa variation lors d'une réaction qui intéresse les chimistes. L'énergie libre de Gibbs standard de réaction,  , est définie par
, est définie par

ou encore, en termes d'énergie libre standard de formation des différentes espèces (réactifs ou produits) impliquées dans la réaction

On trouve dans les manuels de chimie physique des tableaux d'énergie libre standard de formation des composés les plus communs, par exemple, les tableaux (2.5) et (2.6) de Atkins. À T constante, l'énergie libre de réaction est bien entendu reliée à l'enthalpie et l'entropie de réaction par

L'usage de cette relation permet de comprendre par exemple comment une réaction endothermique peut se produire: pour une telle réaction,  est positive, de sorte que du point de vue `enthalpique' (variation d'entropie de l'environnement), la réaction n'est guère favorisée. Cependant, si
est positive, de sorte que du point de vue `enthalpique' (variation d'entropie de l'environnement), la réaction n'est guère favorisée. Cependant, si 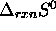 est suffisamment positive, le facteur dit `entropique', associé à l'accroissement de l'entropie du système réactionnel en propre, peut l'emporter et donner une variation d'entropie nette (variation de l'entropie de l'univers) positive, ou encore un
est suffisamment positive, le facteur dit `entropique', associé à l'accroissement de l'entropie du système réactionnel en propre, peut l'emporter et donner une variation d'entropie nette (variation de l'entropie de l'univers) positive, ou encore un 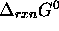 négatif, et la réaction sera spontanée dans le sens considéré.
négatif, et la réaction sera spontanée dans le sens considéré.




Next: Exercices
Up: Thermodynamique: seconde loi
Previous: Troisième loi et
Cours WWW Cinetique Chimique
Wed Jan 8 16:28:09 EST 2003

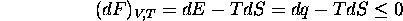

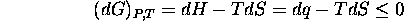




 , est définie par
, est définie par



 est positive, de sorte que du point de vue `enthalpique' (variation d'entropie de l'environnement), la réaction n'est guère favorisée. Cependant, si
est positive, de sorte que du point de vue `enthalpique' (variation d'entropie de l'environnement), la réaction n'est guère favorisée. Cependant, si 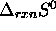 est suffisamment positive, le facteur dit `entropique', associé à l'accroissement de l'entropie du système réactionnel en propre, peut l'emporter et donner une variation d'entropie nette (variation de l'entropie de l'univers) positive, ou encore un
est suffisamment positive, le facteur dit `entropique', associé à l'accroissement de l'entropie du système réactionnel en propre, peut l'emporter et donner une variation d'entropie nette (variation de l'entropie de l'univers) positive, ou encore un 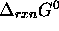 négatif, et la réaction sera spontanée dans le sens considéré.
négatif, et la réaction sera spontanée dans le sens considéré.