
Contrairement à l'enthalpie, qui ne peut-être définie que d'une façon relative, l'entropie d'une substance peut se définir et se calculer de façon absolue. L'entropie (standard) d'une substance, A, à une température T (et à P fixée), peut se calculer par
En écrivant ceci, on a implicitement fait appel au fait que S est une fonction d'état, pour laquelle la loi de Hess s'applique, et que, similairement à la loi de Kirchoff, la variation d'entropie accompagnant une variation de température à P constante est donnée par une intégrale de  sur T, eq.(4.45).
À ce terme de chauffage, s'ajoute les variations d'entropie associées aux différents changements de phase, eq.(4.46), que la substance A aurait à subir quand l'on passe du zéro absolu à la température T d'intérêt.
sur T, eq.(4.45).
À ce terme de chauffage, s'ajoute les variations d'entropie associées aux différents changements de phase, eq.(4.46), que la substance A aurait à subir quand l'on passe du zéro absolu à la température T d'intérêt.
L'entropie d'une substance serait donc bien définie et connue si l'on connait sa valeur au zéro absolu. La troisième loi reconnait que,

Selon la définition statistique de l'entropie,eq.(4.6), cette troisième loi n'est guère étonnante: elle ne fait que refléter l'état d'ordre absolu que l'on aurait à  , car selon la loi de Maxwell-Boltzmann, le système serait alors forcément à l'état fondamental du point de vue de tous les types de mouvements envisageables. La valeur de l'entropie absolue d'une substance calculée par eq.(4.47) est appelée entropie selon le troisième principe. La figure 4.2 illustre ceci sur l'exemple de
, car selon la loi de Maxwell-Boltzmann, le système serait alors forcément à l'état fondamental du point de vue de tous les types de mouvements envisageables. La valeur de l'entropie absolue d'une substance calculée par eq.(4.47) est appelée entropie selon le troisième principe. La figure 4.2 illustre ceci sur l'exemple de  dont la capacité calorifique molaire
dont la capacité calorifique molaire 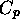 varie avec la température selon le mode montré au panneau (a). L'entropie molaire selon le troisème principe montrée au panneau (b) a été calculée à l'aide de eq.(4.47) avec
varie avec la température selon le mode montré au panneau (a). L'entropie molaire selon le troisème principe montrée au panneau (b) a été calculée à l'aide de eq.(4.47) avec  à
à  et
et  à
à  . On trouve dans la littérature, dont tout manuel de chimie physique sérieux, des tables d'entropie selon le troisième principe, (tableaux 2.5, 2.6 du livre de Atkins par exemple).
. On trouve dans la littérature, dont tout manuel de chimie physique sérieux, des tables d'entropie selon le troisième principe, (tableaux 2.5, 2.6 du livre de Atkins par exemple).

Figure 4.2: (a)Variation de la capacité calorifique molaire à pression constante de 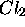 avec la température.Notez les discontinuités dans
avec la température.Notez les discontinuités dans  aux températures de transitions de phase. (b) Entropie selon le troisième principe de
aux températures de transitions de phase. (b) Entropie selon le troisième principe de 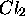 en fonction de la température.
en fonction de la température.
Un survol rapide de ce type de données permet de vérifier notre intuition et notre compréhension de la complexité (qui est reliée au désordre) moléculaire.
 ,
, 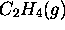 et
et  , c'est
, c'est  qui sera caractérisée par la valeur de l'entropie la plus élevée.
qui sera caractérisée par la valeur de l'entropie la plus élevée.
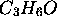 que sont l'acétone (structure ouverte) et l'oxyde de triméthylène (structure cyclique), c'est l'acétone qui aurait une entropie plus élevée.
que sont l'acétone (structure ouverte) et l'oxyde de triméthylène (structure cyclique), c'est l'acétone qui aurait une entropie plus élevée.