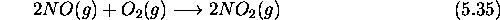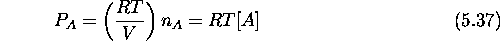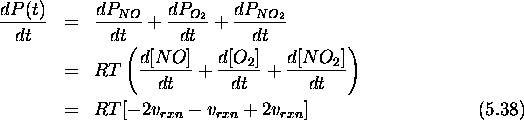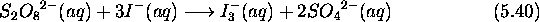Il s'agit d'une méthode in situ, utilisable dans le cas de r éactions en phase gazeuse, ou impliquant un dégagement ou une consommation de gaz. La plupart du temps, on mesure la pression totale, P, de gaz, à volume et température constants. On peut relier P au degr é d'avancement de la réaction et donc aux concentrations des diff érentes espèces. Pour ce faire, il est d'usage d'utiliser la loi des gaz parfaits, ce qui est tout à fait justifié si P est relativement faible.
Exemple
Considérons, à titre d'exemple, la réaction
Soit  ,
, 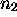 le nombre de moles de NO et de
le nombre de moles de NO et de 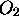 ,
respectivement, au temps t=0, le produit
,
respectivement, au temps t=0, le produit 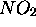 étant supposé
absent à cet instant initial. Soit
étant supposé
absent à cet instant initial. Soit  le degré d'avancement de
la réaction, de sorte qu'au temps t>0, l'on a
le degré d'avancement de
la réaction, de sorte qu'au temps t>0, l'on a 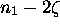 moles de
NO,
moles de
NO, 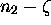 moles de
moles de 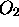 et
et 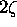 moles de
moles de 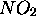 . La
pression totale,
. La
pression totale, 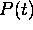 , au temps t est alors reliée à
, au temps t est alors reliée à  par
par
La première ligne de eq.(5.36) n'est rien d'autre que
l'expression de la loi de Dalton, 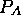 étant la pression partielle de
A. Elle est reliée à la concentration
étant la pression partielle de
A. Elle est reliée à la concentration 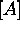 par
par
Ainsi, si l'on différencie la première ligne de eq.(5.36) par rapport à t, on obtient
d'où
De eq.(5.36), on peut aussi tirer  , donc les diverses
concentrations instantanées, en termes de
, donc les diverses
concentrations instantanées, en termes de 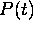 et de la pression
initiale
et de la pression
initiale  .
.
Utilisable en phase gazeuse mais surtout utilisée en phase liquide, cette méthode permet des mesures soit in situ ou en prises d'essai. Elle est basée sur le fait que des substances différentes absorbent dans des régions spectrales différentes, et que pour une lumière appropriée à une substance A donnée, l'absorbance est proportionnelle à la concentration de A (loi de Beer-Lambert). Ceci permet, par un choix judicieux de la lumière incidente de suivre l'évolution d'une espèce donnée.
Exemple
La réaction
peut être suivie par spectrophotométrie en suivant l'évolution
de 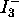 qui est la seule espèce absorbant de façon notable
vers
qui est la seule espèce absorbant de façon notable
vers  .
.