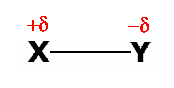Moment dipolaire
Définition
Deux charges égales en valeur absolue mais de signe opposé, +q et -q, séparées par une distance r, constituent un dipôle. On le caractérise un vecteur de module égal au produit q×r, orienté, par convention, de la charge négative à la charge positive (du - vers le +).
Par exemple, dans une molécule diatomique polaire, chaque atome porte une charge partielle δ ou -δ, où 0 < δ < |Qe|:
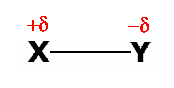
Le moment dipolaire est alors un vecteur qui se dirige vers l'atome le moins électronégatif:
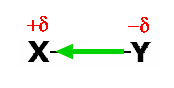
Note: Il existait auparavant deux conventions contradictoires: la convention maintenant établie, et une convention opposée, dite des chimistes, dans laquelle le moment dipolaire est orientée de la charge positive à la charge négative. On trouve encore dans les volumes de référence l'une ou l'autre de ces conventions. Il est important de noter que la confusion n'est qu'apparente et que la seule chose qui change d'une convention à l'autre, c'est la représentation graphique du moment dipolaire; bien entendu, la position des charges positive et négative ne change pas, l'atome le plus électronégatif restant le plus électronégatif dans les deux représentations.
Unités de moment dipolaire
Les dimensions de moment dipolaire sont charge × distance. Les unités SI sont donc C.m. On utilise aussi le debye (D):
1 D = 3.33564×10-30 C.m
Illustrations
i.1
LiH est une molécule comportant une liaison polaire. La charge partielle sur chaque atome vaut 53% d'une charge électronique. La longueur de la liaison est 1.59Å.
- Lequel des deux atomes porte la charge partielle négative?
- Que vaut le moment dipolaire de la molécule?
- Représentez l'orientation du vecteur moment dipolaire par rapport à la liaison Li-H.
a) H, car le plus électronégatif; b) 4.05 D.
i.2
La distance entre les deux atomes de la molécule de HCl est égale à 1.26 Å. Le moment dipolaire expérimental du gaz est 1.08 D. Calculer le caractère ionique de la liaison. S'agit-il d'une liaison covalente pure, covalente peu polaire, covalente très polaire ou ionique?
17.9% - Solution détaillée
Moment dipolaire expérimental de quelques molécules
1 Debye (D) = 3.33564×10-30 C.m (unité SI)
| composé | μ (D) |
| HF | 1.826 |
| HCl | 1.109 |
| HBr | 0.827 |
| HI | 0.448 |
| composé | μ (D) |
| CH3F | 1.858 |
| CH3Cl | 1.896 |
| CH3Br | 1.820 |
| CH3I | 1.640 |
| composé | μ (D) |
| H2O | 1.855 |
| H2S | 0.978 |
| NH3 | 1.472 |
| composé | μ (D) |
| CO | 0.110 |
| CO2 | 0 |
| NO | 0.159 |
| NO2 | 0.316 |
| SO2 | 1.633 |
| solvant | μ (D) |
| Acétonitrile CH3CN | 3.925 |
| Diméthylsulfoxyde (CH3)2SO | 3.96 |
| Acétone (CH3)2CO | 2.88 |
| Méthanol CH3OH | 1.70 |
| Éthanol C2H5OH | 1.69 |
| Éther diéthylique (C2H5)2O | 1.098 |
| Chloroform CHCl3 | 1.04 |
| Toluène C7H8 | 0.375 |
Moment dipolaire moyen, calculé pour quelques liaisons chimiques
| liaison | μ (D) |
| H-F | 1.92 |
| H-Cl | 1.08 |
| H-Br | 0.78 |
| H-I | 0.4 |
| liaison | μ (D) |
| H-C | 0.4 |
| H-O | 1.5 |
| H-N | 1.3 |
| H-P | 0.4 |
| liaison | μ (D) |
| C-F | 1.4 |
| C-Cl | 1.5 |
| C-Br | 1.4 |
| C-I | 1.2 |
| liaison | μ (D) |
| C-N | 0.2 |
| C-O | 0.7 |
| C=O | 2.3 |
Pour une molécule contenant plusieurs liaisons polaires, le moment dipolaire de la molécule est la résultante des vecteurs moments dipolaires de chacune des liaisons:
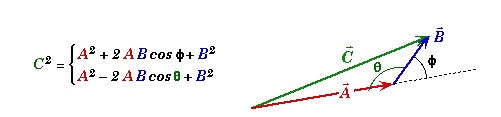
Illustrations
i.3
Les deux liaisons H-O de la molécule d'eau font un angle égal à 104.45°. Sachant que le moment dipolaire expérimental de l'eau est égal à 1.8546 D, calculer le moment dipolaire que l'on peut associer à la liaison H-O.
1.514 D - Solution détaillée
Laquelle des deux molécules ci-dessous possède le plus grand moment dipolaire:

Représentez dans chaque cas comment s'oriente le moment dipolaire par rapport à la molécule.
i.5
Calculez le moment dipolaire de la liaison NH à partir du moment dipolaire de l'ammoniac NH3, en supposant que l'ammoniac possède une structure parfaitement tétraédrique.
1.472 D
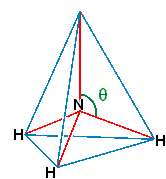
i.6
Dans l'illustration précédente, on a supposé que l'ammoniac NH3 possède une structure parfaitement tétraédrique. Si on considère plutôt que le moment dipolaire de la liaison N-H est 1.30 D, calculez l'angle θ ci-dessous, à partir du moment dipolaire expérimental de l'ammoniac.
112°