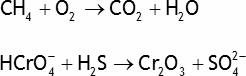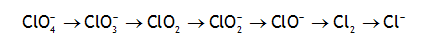Oxydoréduction — Exercices et problèmes
7.1
Donnez le degré d'oxydation de chacun des atomes des espèces ci-dessous
| K2CrO4 |
Al(OH)3 |
NO2¯ |
| Pb |
IO3¯ |
NO3¯ |
| H3PO4 |
SO3 |
NH4+ |
| acétaldéhyde (structure) |
Na2SO3 |
SO32¯ |
| CaH2 |
Rb2SO4 |
SO42¯ |
| OF2 |
Fe2S3 |
S4O62¯ (structure) |
| CN¯ |
Li2O |
S2O62¯ |
| NH4Br |
CCl4 |
HCO3¯ |
| AsO43¯ |
N2 |
CH3OH |
| Fe3+ |
Fe3O4 |
CH4 |
| XeO4 |
NaN3 |
CO2 |
Réponses
7.2
Équilibrez les réactions suivantes:
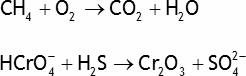
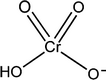
Notez la structure de l'ion hydrogénochromate HCrO4¯, acide faible et base conjuguée d'un acide fort, l'acide chromique H2CrO4:
Réponses
7.3
Écrivez toutes les demi-réactions permettant, en milieu acide, de passer successivement par chacun des divers états d'oxydations du chlore:
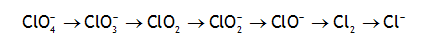
Réponses
7.4
Écrivez les demi-réactions et équilibrez les réactions d'oxydoréduction suivantes:

Réponses
7.5
Équilibrez la réaction de réduction de CCl2=CHCl en CH2=CH2 par le fer Fe (Ce dernier s'oxyde en Fe2+).
CCl2=CHCl + 3H+ + 3Fe → CH2=CH2 +3Cl¯ + 3Fe2+
7.6
Comparez l'énergie libre standard de la réaction ΔG° de la réaction:
Zn (s) + Cl2 (g) → Zn2+ + 2 Cl¯
calculée à partir des énergies libres de formation standard et à partir des potentiels standard de réduction.
-409.52 et -409.06 kJ.mol-1, essentiellement égaux, à 0.1% près.
7.7
Une mine rejète des eaux contenant des ions Cu+ et Cu2+ à une concentration totale de 10¯4M. La mesure du potentiel de réduction du couple Cu2+/Cu+ dans les eaux rejetées est 0.675 V à 25ºC. En négligeant les effets de force ionique, calculez la concentration de Cu+.
[Cu+]=1.896×10-13M
7.8
On trempe un barreau de cadmium Cd (s) dans des solutions aqueuses des ions suivants, tous ayant une activité égale à 1: H+, Mn2+, Cu+, Fe3+, Co2+, et Al3+. Dans quelles solutions verra-t-on une oxydation spontanée du cadmium?
H+, Cu+, Fe3+, Co2+
7.9
Déterminez le produit de solubilité de AgCl à partir du potentiel standard E° des couples Ag+/Ag et AgCl/Ag.
1.746×10-10
7.10
À l'aide du
diagramme de Latimer pour le chlore en milieu basique, calculez E°
ClO3¯/OCl¯. Montrez que OCl¯ se transforme spontanément en milieu basique en ClO
3¯ et Cl¯. Donnez la réaction de dismutation équilibrée.
0.50 V; 3OCl¯ → ClO3¯ + 2Cl¯
7.11
On s'intéresse aux espèces du soufre en solution aqueuse.
- Laquelle se dismute spontanément en milieu acide mais est stable en milieu basique?
- Laquelle est stable en milieu acide mais se dismute en milieu basique?
S2O3¯ et S
7.12
Le nitrate d'ammonium NH4NO3 est un solide utilisé comme engrais en agriculture. C'est aussi un composé qui peut, dans certaines circonstances, se décomposer violemmment par médiamutation, donnant l'oxyde nitreux N2O (g) et H2O (g). Donnez l'équation équilibrée de la réaction d'oxydo-réduction et calculez son potentiel standard.
0.438 V

![]()