
Ions en solution — Exercices et problèmes
6.1
Calculez le coefficient d'activité des ions suivants, dans une solution de force ionique I indiquée entre parenthèses:
a) S2- (I=0.001)
b) PO43- (I=0.001)
c) Sn4+ (I=0.05)
a) 0.8685; b) 0.7260; c) 0.0982
6.2
6.3
À l'aide des données thermodynamiques, calculez le produit de solubilité du chlorure d'argent à 25°C et 60°C.
1.77×10-10; 2.83×10-9
6.4
La solubilité de l'iodate de cérium Ce(IO3)3 extrapolée à force ionique nulle à 25°C est 0.001855 M. Calculez Ksp.
3.2×10-10
6.5
La solubilité de Ag2S extrapolée à force ionique nulle à 25°C est 1.26×10-16 M. Calculez Ksp.
8.0×10-48
6.6
Calculez la solubilité de Ag2CrO4 (exprimée en mole par litre) dans (a) 0.050 M KClO4 (b) 0.005 M AgNO3
a) 9.936×10-5 M; b) 7.097×10-8 M
6.7
Calculez la solubilité du chromate de plomb PbCrO4 (a) à force ionique nulle et (b) dans une solution 10-3M de chromate de potassium K2CrO4.
(a) 5.29×10-7M; (b) 4.51×10-10M.
6.8
Calculez la solubilité du fluorure de magnésium MgF2 (a) à force ionique nulle; (b) dans une solution 0.10 M de fluorure de sodium NaF et (c) dans une solution 0.03 M de chlorure de magnesium MgCl2.
(a) 2.424×10-4M; (b) 2.164×10-8M (c) 4.155×10-5M.
6.9
On mélange du sulfate de calcium CaSO4 (Ksp=9.1×10-6) et du sulfate de strontium SrSO4 (Ksp=3.2×10-7) et de l'eau à 25°C. Calculez la concentration de chaque espèce en solution à l'équilibre, sachant qu'il reste alors un peu de chaque solide en excès. On négligera les effets de force ionique.
[Sr2+]=1.04×10-4M; [Ca2+]=2.97×10-3M ([SO42-]=3.07×10-3M.
6.10
Classez les acides suivants en ordre croissant de force: acide acétique, acide fluoroacétique, acide trifluoroacétique, acide chloroacétique. Proposez une explication pour la différence de force entre ces acides.
6.11
À l'aide des valeurs de pK
W en fonction de la température (recueil de données) ci-dessus, calculez l'enthalpie de la réaction d'autoprotolyse de l'eau. On utilisera un graphique et un calcul de régression linéaire.
56.55.kJ.mol-1 - Solution détaillée
6.12
On considère une solution aqueuse contenant c
T moles par litre de HCl, un acide fort complètement dissocié. À partir des équations de conservation de la matière et d'électroneutralité de la solution, démontrez que dans la solution:
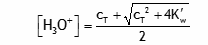
Solution détaillée
6.13
On dissout dans l’eau de l’acétate d’ammonium, un électrolyte fort. On ajuste ensuite le pH de la solution avec HCl ou NaOH. Sans aucun calcul:
- Tracez schématiquement, sur une même figure, la fraction de chacune des espèces en solution provenant de l’acétate d’ammonium initial, en fonction du pH;
- Quelles sont, parmi ces espèces, les deux les plus abondantes à pH=4 ? pH=7 ? pH=10 ?
Solution détaillée
6.14
L'histidine est un acide aminé qui existe dans l'eau sous quatre états d'ionisations:
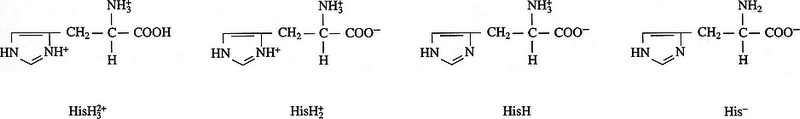
Quelles sont les deux espèces les plus abondantes en solution à 25°C et pH=7?
HisH2+ et HisH
6.15
À 25ºC, le produit de solubilité de l'hydroxyde de calcium Ca(OH)2 est 8.0×10-6. En négligeant les effets de force ionique et sachant que pKw=14.0, calculez la solubilité du solide à pH=12.6.
5.05×10-3 M
6.16
Calculez le pH d'une eau à 25°C en équilibre avec l'atmosphère terrestre, qui contient 10-3.15 atm de dioxyde de carbone. On négligera les effets de force ionique.
5.49
Exercices et problèmes dans le volume de Chang
8.8, 8.9 et 8.11.
Énoncés - Table de données - Réponses
5.49

![]()
![]()
