

| 5.1 | Décrire la différence de densité électronique et d'énergie entre l'orbitale liante et l'orbitale anti-liante qui résultent de la combinaison linéaire de deux orbitales atomiques. |
|
|
| 5.2 |
Décrire comment deux orbitales atomiques p se recouvrent pour former soit deux orbitales moléculaires |
|
|
| 5.3 | Comment varient l'énergie et la longueur d'une liaison lorsque l'ordre de liaison augmente ? |
|
|
| 5.5 | Écrire la configuration électronique de l'état fondamental et du premier état excité de N2. Ces deux états possèdent-ils les mêmes propriétés magnétiques? |
|
|
| 5.6 | Déterminer la configuration électronique et l'ordre de liaison (O.L.) des espèces H2, B2 et F2. Lesquelles sont paramagnétiques? |
|
|
| 5.7 | A l'aide d'un diagramme d'énergie des orbitales atomiques et des orbitales moléculaires, prédire laquelle parmi les deux espèces F et F2 possède la plus grande énergie de première ionisation. |
|
|
| 5.13 |
À l'aide du tableau suivant, qui donne l'énergie de première ionisation, I1, l'affinité électronique, Ae, et l'énergie de dissociation,
Calculer le changement d'énergie associé à:
|
| 5.14 |
Deux charges de même valeur absolue mais de signe opposé + |
| 5.15 |
La distance entre les deux atomes de la molécule de HC |
|
|
| 5.16 |
Calculer le caractère ionique de la liaison dans les halogénures métalliques suivants:
|
||||||||||||||||||
| 5.17 |
Classer les liaisons suivantes de la moins polaire à la plus polaire: C-N, Li-F, H-H, O-H, C-C, S-O |
|
|
| 5.18 | Pour une molécule contenant plusieurs liaisons polaires, le moment dipolaire de la molécule est la résultante des vecteurs moments dipolaires de chacune des liaisons. Les deux liaisons H-O de la molécule d'eau font un angle égal à 105°. Sachant que le moment dipolaire expérimental de l'eau est égal à 1.85 D, calculer le moment dipolaire que l'on peut associer à la liaison H-O. |
|
|
| 5.19 |
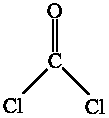 On considère la molécule de phosgène OCCl2, représentée ci-contre, et dont le moment dipolaire est égal à 1.17 D. À l'aide des données de l'aide-mémoire: On considère la molécule de phosgène OCCl2, représentée ci-contre, et dont le moment dipolaire est égal à 1.17 D. À l'aide des données de l'aide-mémoire:
|
|
|