

| 6.1 |
Un condensateur plan possède la géométrie suivante: distance d = 0.2 cm; surface A = 100 cm2. On applique une différence de potentiel
|
| Réponses: (a) Co=4.427×10 -11 F; Qo = 8.854×10 -9 C; (b) C = 2Co ; Q = 2Qo . |
| 6.2 | Calculer le moment dipolaire induit dans une molécule d'eau par un champ électrique de 1.0 kV.cm-1. |
| Réponse: 4.8 µD. |
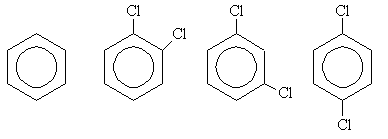
| 6.3 |
Représenter, schématiquement et sur la même figure, la polarisation molaire des quatre composés suivants en fonction de l'inverse de la température. Justifier le tracé.
|
| 6.4 |
La constante diélectrique du dioxyde de soufre SO2 gazeux, mesurée sous une pression constante égale à 1 atm, est 1.00993 à 0°C et 1.00569 à 100°C.
|
| Réponses: (a) µ = 1.634 D; (b) non, car son moment dipolaire n'est pas nul, ce qui indique que la l'angle O-S-O n'est pas 180°. |
| 6.6 |
On a mesuré la densité et la constante diélectrique du chloroforme CHCl3 liquide et solide en fonction de la température:
|
| 6.7 |
Calculer la polarisabilité de CH4 (g), CCl4(g) et CCl4(
|
||||||||||||||||||||
|
|
| 6.8 |
On a mesuré la constante diélectrique de la vapeur de BrF5 en fonction de la température, sous pression atmosphérique constante (P = 1 atm):
|
||||||||||||||||
|
|