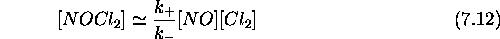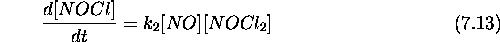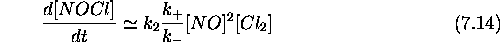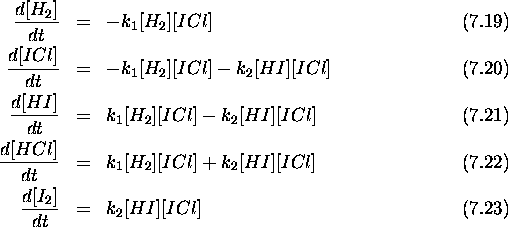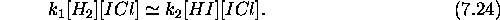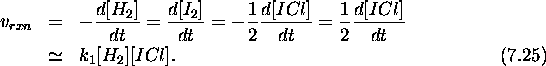Exemple
Pour illustrer l'utilisation de ce genre d'hypothèse, analysons le
mécanisme de la formation de NOCl à partir de NO et 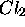 , eqs.(
7.8) et (7.9) dont le bilan est clairement
l'équation st
, eqs.(
7.8) et (7.9) dont le bilan est clairement
l'équation st chiométrique (7.6). L'hypothèse de pré-équilibreOn considère
que l'équilibre dans eq.(7.8) est rapidement établi.
On peut alors écrire
chiométrique (7.6). L'hypothèse de pré-équilibreOn considère
que l'équilibre dans eq.(7.8) est rapidement établi.
On peut alors écrire
Considérons maintenant la vitesse de formation du produit final NOCl, qui représente aussi la vitesse de la réaction globale (7.6).
Substituant l'expression obtenue pour 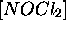 , eq.(7.12) dans
eq.(7.13), on obtient
, eq.(7.12) dans
eq.(7.13), on obtient
ce qui clairement de la forme observée, eq.(7.7), avec
Vérifions que l'on obtient la même forme avec la vitesse de consommation de NO:
Dans d'autres cas, des espèces instables, par exemples des radicaux, apparaissent comme intermédiaires dans le mécanisme réactionnel. Pour ces espèces, en raison de leur présence en très faible quantité, on peut raisonnablement leur appliquer l' hypothèse de l'état stationnaire. Cette hypothèse s'applique aussi à des intermédiaires stables mais qui sont consommés rapidement dans le mécanisme.
Exemple
Par exemple la cinétique de la réaction (7.10) peut se rationaliser par le mécanisme suivant:
avec  . On vérifie tout d'abord que le bilan de ces deux
réactions consécutives est bien l'équation st
. On vérifie tout d'abord que le bilan de ces deux
réactions consécutives est bien l'équation st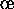 chiométrique (7.10). Il nous reste à vérifier que ce mécanisme rend bien compte
de la loi de vitesse observée, eq.(7.11). Dans un premier temps,
écrivons les équations de vitesse régissant l'évolution de
différentes espèces:
chiométrique (7.10). Il nous reste à vérifier que ce mécanisme rend bien compte
de la loi de vitesse observée, eq.(7.11). Dans un premier temps,
écrivons les équations de vitesse régissant l'évolution de
différentes espèces:
Comme  , par hypothèse, l'espèce intermédiaire HI est
rapidement consommée au fur et à mesure qu'elle se forme, de sorte
qu'elle n'existerait qu'en très faible quantité. On peut invoquer
l'hypothèse de l'état stationnaire pour cette espèce, et écrire
, par hypothèse, l'espèce intermédiaire HI est
rapidement consommée au fur et à mesure qu'elle se forme, de sorte
qu'elle n'existerait qu'en très faible quantité. On peut invoquer
l'hypothèse de l'état stationnaire pour cette espèce, et écrire 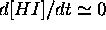 , ce qui donne, de eq.(7.21)
, ce qui donne, de eq.(7.21)
Substituant ce résultat dans les eqs.(7.19-7.23), on trouve finalement
Le mécanisme proposé permet en effet de rendre compte de la loi de vitesse observée avec