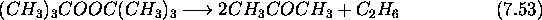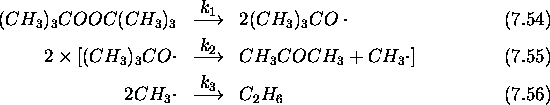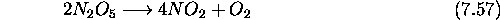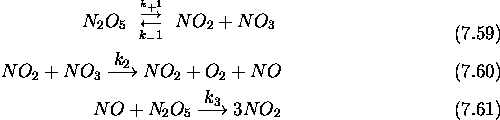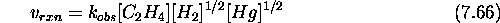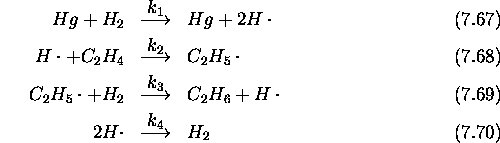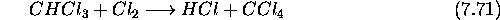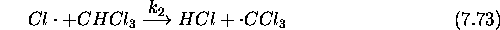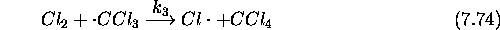suit une loi cinétique empirique du premier ordre. Le mécanisme suivant a été proposé pour cette réaction:
Évaluons le mécanisme proposé:
- Vérifiez le bilan st
 chiométrique du mécanisme.
chiométrique du mécanisme.
- En supposant que toutes les espèces radicalaires impliquées dans
le mécanisme sont dans un état stationnaire, montrez que le mécanisme
proposé rend bien compte de la loi de vitesse observée.
- Quelle est l'étape déterminante dans ce mécanisme?
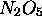
suit une loi de vitesse du premier ordre
Différents mécanismes ont été proposés. Le plus vraisemblable est le mécanisme suivant dit mécanisme de Ogg:
- Vérifiez que le bilan du mécanisme est bien l'équation
stoéchiométrique (7.57).
- En admettant que les intermédiaires réactifs
 et NO sont
présents en très petite quantité, vérifiez que le mécanisme de Ogg
rend bien compte de la loi de vitesse observée.
et NO sont
présents en très petite quantité, vérifiez que le mécanisme de Ogg
rend bien compte de la loi de vitesse observée.
- Qu'advient-il si l'on utilise l'hypothèse de pré-équilibre plutôt?
 , par l'ion hexacyanoferrate (III) en milieu aqueux acide selon l'équation st
, par l'ion hexacyanoferrate (III) en milieu aqueux acide selon l'équation st chiométrique
chiométrique
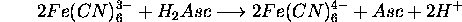
on a proposé le mécanisme suivant
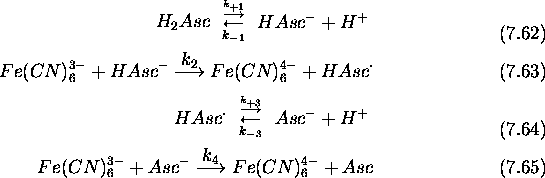
En applicant l'hypothèse de l'état stationnaire à  ,
,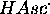 et
et  , montrez que, dans le cas où
, montrez que, dans le cas où  , la loi de vitesse prédite par ce mécanisme rejoint la forme observée expérimentalement à un pH imposé:
, la loi de vitesse prédite par ce mécanisme rejoint la forme observée expérimentalement à un pH imposé:

Exprimez 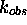 en termes des constantes de vitesse des étapes élémentaires du mécanisme précédent et en terme de
en termes des constantes de vitesse des étapes élémentaires du mécanisme précédent et en terme de  .
.
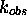 est-elle
reliée aux diverses constantes de vitesse définie dans le mé
canisme?
est-elle
reliée aux diverses constantes de vitesse définie dans le mé
canisme?
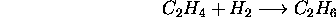
Expérimentalement, on a trouvé que cette réaction suit la loi de vitesse
Pour expliquer ce résultat, le mécanisme en chaîne suivant a été proposé:
- Identifiez:
- les porteurs de chaîne,
- les différentes phases de ce mécanisme.
- En considérant la vitesse de formation de
 , montrez que le mécanisme proposé rend bien compte de la cinétique observée.
, montrez que le mécanisme proposé rend bien compte de la cinétique observée.
Justifiez toute approximation utilisée.
on a proposé le mécanisme en chaînes suivant