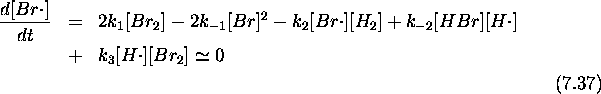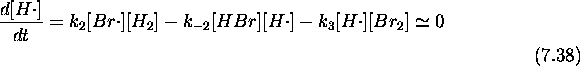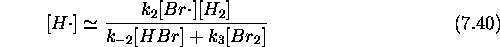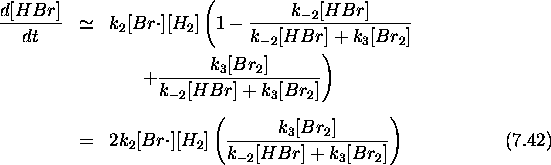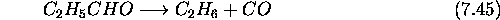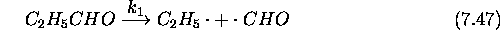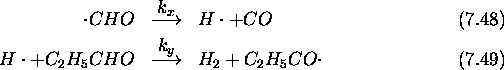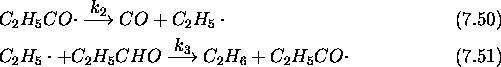La loi de vitesse observée est de la forme
où k et C sont deux constantes. On a proposé le mécanisme en chaînes suivant
On vérifie aisément que le bilan des 2 étapes de la phase de propagation représente bien la réaction (7.30). Vérifions maintenant que le mécanisme rend bien compte de la loi de vitesse observée. Pour ce faire, appliquons d'abord l'hypothèse de l'état stationnaire aux deux radicaux porteurs de chaînes
Substituant eq.(7.38) dans (7.37), il vient
D'autre part, directement de eq.(7.38), on tire la relation suivante:
On peut substituer ce résultat dans l'équation de vitesse pour le produit principal, HBr,
pour obtenir
Finalement, substituant eq.(7.39) dans cette dernière expression, on trouve précisément la loi de vitesse de eq.( 7.31) avec
dont la loi de vitesse empirique est
Le mécanisme retenu pour cette réaction est le suivant:
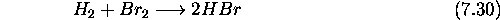

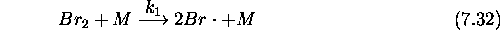
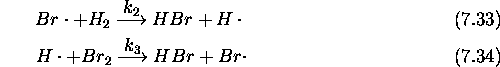
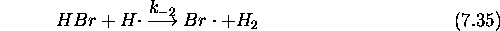

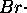 :
: