
On a vu que la chaleur (dq ou q) peut s'identifier à la variation de l'énergie interne E pour des processus isochores (à volume constant). De la même façon, dans le cas des processus isobares (à pression constante), telle que les réactions chimiques, la chaleur peut s'identifier à la variation d'une autre fonction d'état, l'enthalpie, H, définie par
En effet, la différentielle de ceci est
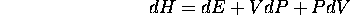
ce qui fait que, à pression constante, 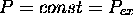 , dP=0, et
, dP=0, et
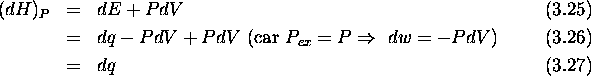
On a donc

définissant la capacité calorifique à pression constante
Remarque:
Les équations (3.28) et (3.30)
sont écrites sous une forme qui suggère que les variables d'état
naturelles dont dépend H sont T et P, c.à d. 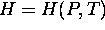 . De
même, eq.(3.12) nous suggère
d'écrire
. De
même, eq.(3.12) nous suggère
d'écrire 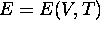 .
.