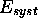 est compensée par une variation
correspondante (et de signe contraire) de l'énergie
est compensée par une variation
correspondante (et de signe contraire) de l'énergie  de
l'environnement, c.à d.
de
l'environnement, c.à d.
Selon la première loi, eq.(3.1), toute variation de
l'énergie du système 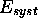 est compensée par une variation
correspondante (et de signe contraire) de l'énergie
est compensée par une variation
correspondante (et de signe contraire) de l'énergie  de
l'environnement, c.à d.
de
l'environnement, c.à d.
pour un changement d'état infinitésimal, ou
pour un processus fini. La variation de l'énergie  ne
dépend que de l'état initial et de l'état final mais peut
généralement se décomposer en plusieurs contributions dont la
nature dépend du chemin suivi. On distingue deux types de contributions
à
ne
dépend que de l'état initial et de l'état final mais peut
généralement se décomposer en plusieurs contributions dont la
nature dépend du chemin suivi. On distingue deux types de contributions
à 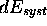 (ou
(ou 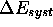 ):
):
pour un déplacement infinitésimal, et
pour un déplacement fini. Dans cette définition, le signe (+) assure
que si les 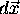 (c.à d. les déplacements dans le système)
sont orientés dans le même sens que la force
(c.à d. les déplacements dans le système)
sont orientés dans le même sens que la force  alors le travail est
compté positivement,
alors le travail est
compté positivement,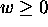 , correspondant à une énergie
fournie au (gagnée par le) système. Dans le cas contraire où les
déplacements se font contre la force externe
, correspondant à une énergie
fournie au (gagnée par le) système. Dans le cas contraire où les
déplacements se font contre la force externe  , le travail ainsi
défini sera négatif dénotant une perte d'énergie du systè
me qui ``effectue'' ce travail.
, le travail ainsi
défini sera négatif dénotant une perte d'énergie du systè
me qui ``effectue'' ce travail.
Le travail que l'on rencontre le plus souvent en thermodynamique est le travail de changement de volume
pour un changement de volume infinitésimal,
pour un changement de volume fini![]()
Le travail est une fonction de passage. Il dépend du chemin suivi lors d'un changement d'état. Les exemples suivants illustrent ce point.
On considère le passage, à tempé
rature T constante, d'un gaz parfait d'un volume initial  à un
volume final
à un
volume final 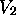 , dans des conditions variées:
, dans des conditions variées:
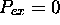
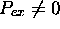 constante:
constante:
On vérifie que  si
si 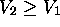 (détente), et
(détente), et 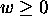 si
si 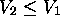 (compression).
(compression).
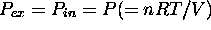 tout au long du processus:
tout au long du processus:
On vérifie ici aussi que 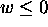 si
si  (détente),
et
(détente),
et 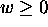 si
si  (compression). On note aussi que le travail fourni dans le cas d'une détente réversible
(compression). On note aussi que le travail fourni dans le cas d'une détente réversible 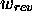 est toujours supérieur à celui d'une détente irréversible, figure 3.2.
est toujours supérieur à celui d'une détente irréversible, figure 3.2.

Figure: Travail accompagnant une détente de gaz parfait. Notez que 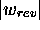 est nécessairement plus grand que
est nécessairement plus grand que 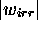 .
.

On peut définir aussi la chaleur comme cette variation d'énergie interne qui est associée à une variation de température à volume constant. On peut alors écrire
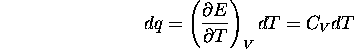
où 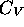 est la capacité calorifique à volume constant
définie au chapitre précédent.
est la capacité calorifique à volume constant
définie au chapitre précédent.
Selon ces définitions, il est clair que la chaleur est aussi une fonction de passage: elle dépend du chemin suivi au cours d'un changement d'état, puisqu'elle n'est identifiable avec une variation d'énergie interne que pour des processus à volume constant. Ceci ne signifie pas que l'on ne peut parler de chaleur que dans ces cas. Au contraire, dans tous les cas, la variation de l'énergie interne peut toujours se décomposer en la somme d'une contribution sous forme ``travail'' et d'une autre sous forme ``chaleur''

avec réduction à
seulement pour un processus à volume constant pour lequel le travail (mécanique, travail de changement de volume) est assurément nul.
Remarques:
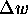 et
et 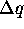 respectivement, pour désigner un
travail et une chaleur accompagnant un changement d'état fini. Ceci pour
souligner que travail et chaleur sont des fonctions de passage, dont la
grandeur dépend du chemin suivi. On réserve la notation
respectivement, pour désigner un
travail et une chaleur accompagnant un changement d'état fini. Ceci pour
souligner que travail et chaleur sont des fonctions de passage, dont la
grandeur dépend du chemin suivi. On réserve la notation 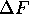 pour désigner la variation finie d'une fonction d'état F, c.à
d. pour signifier
pour désigner la variation finie d'une fonction d'état F, c.à
d. pour signifier 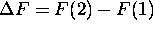 . Dans la version infinitésimale,
. Dans la version infinitésimale,  dans dq et dw ne désigne pas une différentielle comme
d'habitude, mais simplement une quantité infinitésimale. On dit
parfois que ce sont des ``différentielles inexactes''. Certains textes
soulignent ceci en ajoutant une barre au d.
dans dq et dw ne désigne pas une différentielle comme
d'habitude, mais simplement une quantité infinitésimale. On dit
parfois que ce sont des ``différentielles inexactes''. Certains textes
soulignent ceci en ajoutant une barre au d.
Exemples
À titre d'exemples, revenons aux trois processus de détente ou de compression isotherme d'un gaz parfait considérés ci-haut, et calculons la chaleur impliquée dans chacun de ces trois cas. Pour ce faire, rappelons que, pour un gaz parfait, l'énergie interne ne dépend que de la température T. Dans un processus isotherme, T est fixée, donc
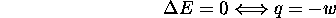
dans ces trois cas. On a donc:
Détente adiabatique réversible d'un gaz parfait monoatomique
Pour illustrer les concepts de travail et de chaleur dans l'application de la première loi, considérons le processus de détente adiabatique réversible
d'un gaz parfait monoatomique. On s'attend à ce que 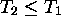 , puisque le
système effectue du travail sans gain de chaleur de la part de
l'environnement. Il sent donc une perte nette de l'énergie.
Vérifions ceci.
, puisque le
système effectue du travail sans gain de chaleur de la part de
l'environnement. Il sent donc une perte nette de l'énergie.
Vérifions ceci.
Écrivons d'abord, pour une variation infinitésimale d'état le long du chemin adiabatique

puisque l'énergie d'un gaz parfait ne dépend que de T. En fait,
comme le gaz est monoatomique, on peut même écrire [ ,
voir eq.(1.38) du chapitre 1]
,
voir eq.(1.38) du chapitre 1]
D'autre part, comme ce processus est adiabatique  , de sorte que
, de sorte que
Combinant eq.(3.21) et eq.(3.22), on obtient

d'où l'on tire, par intégration
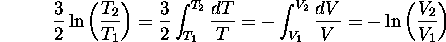
donc
Comme  dans une détente, on conclut que
dans une détente, on conclut que
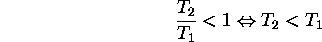

Figure 3.3: Différence entre une détente isotherme et une détente adiabatique de gaz parfait. Partant d'un même état initial, la détente adiabatique mène le système à un état final de plus basse température que le processus isotherme.