 d'une substance l'enthalpie de formation de
(1 mole de) cette substance dans son état standard, c.à d.
sous sa forme stable à P=1 atm, et à T fixée,
généralement
d'une substance l'enthalpie de formation de
(1 mole de) cette substance dans son état standard, c.à d.
sous sa forme stable à P=1 atm, et à T fixée,
généralement  K, à partir des
éléments, pris dans leur état standard également.
K, à partir des
éléments, pris dans leur état standard également.
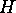 partout par
partout par 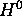 :
:
Par la définition même d'une enthalpie standard, on a en particulier
pour la réaction de formation de tout composé A à partir des éléments.
On trouve dans la littérature des tableaux complets de données thermodynamiques; parmi celles-ci se trouvent les enthalpies standards de formation des principaux composés, les enthalpies standards de changements de phase de différents corps, etc. Par exemple, dans le texte de Atkins, 6e édition, le tableau 2.3 donne les enthalpies de fusion et de vaporisation de plusieurs composés inorganiques et organiques, le tableau 2.5 donne, parmi d'autres données thermodynamiques, l'enthalpie de formation d'un nombre de composés organiques communs. Le tableau 2.6 donne les mêmes données pour des composés inorganiques.
Exemples
- On trouve par exemple, dans le tableau 2.5 de cet
ouvrage,
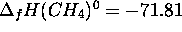
 . Ceci représente
l'enthalpie de la réaction (exothermique)
. Ceci représente
l'enthalpie de la réaction (exothermique)

à
 K et sous P=1
K et sous P=1  On dit aussi que l'enthalpie
standard du méthane est
On dit aussi que l'enthalpie
standard du méthane est 
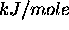 .
.
- La donnée
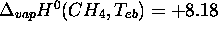
 lue du tableau 2.3 de Atkins est
l'enthalpie standard de la réaction (la transformation de phase)
lue du tableau 2.3 de Atkins est
l'enthalpie standard de la réaction (la transformation de phase)

se produisant à
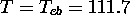 K, la température
d'ébullition du méthane. Ceci signifie aussi que la condensation du
méthane
K, la température
d'ébullition du méthane. Ceci signifie aussi que la condensation du
méthane  à la même
température et sous 1 atm. est exothermique et que son enthalpie
standard vaut
à la même
température et sous 1 atm. est exothermique et que son enthalpie
standard vaut 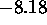
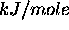 .
.

