
Pour utiliser les données tabulées sur les enthalpies standards de formations, de combustion, de changement de phase, dans le calcul d'une enthalpie de réaction quelconque, se produisant dans des conditions autres que les conditions standards, on fait appel au fait que l'enthalpie est une fonction d'état. Supposons que la réaction

peut se décomposer en plusieurs étapes (elles ne sont pas à être nécessairement réalisables, ni réelles)
alors, comme H est une fonction d'état, on doit avoir
et de façon plus générale, si une réaction peut se décomposer en N étapes, numérotées i=1,2,3..N, alors
Exemples:
Considérons la transformation du graphite en diamant:
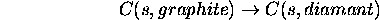
dans des conditions standards normales de température et de pression (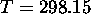 K, P=1 atm). Ce processus, impossible à réaliser,
donc à caractériser par calorimétrie dans ces conditions douces,
peut se représenter par le cycle de Hess suivant
K, P=1 atm). Ce processus, impossible à réaliser,
donc à caractériser par calorimétrie dans ces conditions douces,
peut se représenter par le cycle de Hess suivant
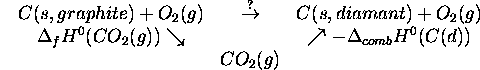
La première réaction dans ce cycle est la formation de 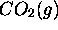 à partir des éléments (la forme définissant l'état
standard du carbone est le graphite), pour laquelle on connait l'enthalpie
standard
à partir des éléments (la forme définissant l'état
standard du carbone est le graphite), pour laquelle on connait l'enthalpie
standard 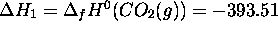
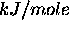 . La
seconde réaction dans le cycle est la réaction opposée à la
combustion du diamant, donc
. La
seconde réaction dans le cycle est la réaction opposée à la
combustion du diamant, donc  . On
trouve au tableau 2.5 de Atkins (dernière colonne), l'enthalpie de
combustion de divers composés organiques, dont le diamant; on y lit
. On
trouve au tableau 2.5 de Atkins (dernière colonne), l'enthalpie de
combustion de divers composés organiques, dont le diamant; on y lit 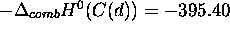
 . Selon ce cycle de Hess, on aura
donc
. Selon ce cycle de Hess, on aura
donc

Cette valeur est d'ailleurs tabulée dans les tableaux 2.5 et 2.6 de Atkins.