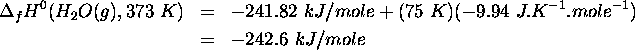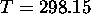 K. La loi de Kirchoff nous
permet de calculer l'effet des variations de température sur les
chaleurs de réaction. Rappelons que l'enthalpie de tout corps, donc de
tout composé, A, change continûment avec la température selon
K. La loi de Kirchoff nous
permet de calculer l'effet des variations de température sur les
chaleurs de réaction. Rappelons que l'enthalpie de tout corps, donc de
tout composé, A, change continûment avec la température selon
Une dernière relation nous est nécessaire pour calculer les
enthalpies de réactions dans toute condition. Les enthalpies standards,
tabulées, ou calculées indirectement en utilisant un cycle de Hess,
sont définies à une température particulière, le plus
souvent la température ambiante 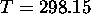 K. La loi de Kirchoff nous
permet de calculer l'effet des variations de température sur les
chaleurs de réaction. Rappelons que l'enthalpie de tout corps, donc de
tout composé, A, change continûment avec la température selon
K. La loi de Kirchoff nous
permet de calculer l'effet des variations de température sur les
chaleurs de réaction. Rappelons que l'enthalpie de tout corps, donc de
tout composé, A, change continûment avec la température selon
où 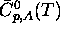 est la capacité (molaire). Pour une
réaction, on a donc, de eq.(3.33),
est la capacité (molaire). Pour une
réaction, on a donc, de eq.(3.33),
Définissons

L'équation précédente s'écrit alors plus simplement, (loi de Kirchoff différentielle)
Intégrant de  la température de l'état standard,
jusqu'à T, la nouvelle température, on obtient la loi de Kirchoff
sous forme intégrale:
la température de l'état standard,
jusqu'à T, la nouvelle température, on obtient la loi de Kirchoff
sous forme intégrale:
Exemple:
L'enthalpie standard de formation de 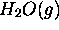 à
à 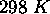 est
est
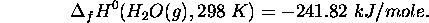
Les capacités calorifiques à P constante de  ,
,  et
et  valent respectivement
valent respectivement 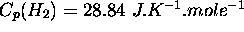 ,
, 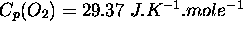 ,
, 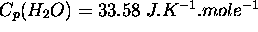 . En considérant que ces valeurs sont maintenues constantes de
. En considérant que ces valeurs sont maintenues constantes de 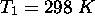 à
à 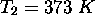 , on peut calculer la valeur de
, on peut calculer la valeur de 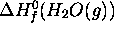 à
à 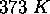 par
par
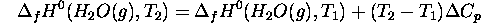
où
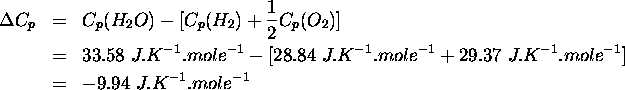
On a donc