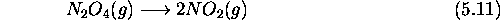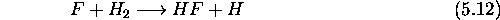- ne peuvent être décomposées en étapes plus simples
- réflètent un évènement moléculaire, une collision réactive telle que celle modélisée au chapitre 2 dans le cadre de la théorie cinétique des gaz.
Propriétés: Toute réaction élémentaire est caractérisée par les propriétés suivantes:
- son ordre global est aussi sa molécularité. Il
indique le nombre de molécules actuellement impliquées dans le
processus moléculaire dont la réaction en est la manifestation.
Exemples
- La réaction
est unimoléculaire, et est du 1er ordre.
- La réaction
est bi-moléculaire, et est du second ordre.
- La réaction
- l'ordre d'une réaction élémentaire est toujours entier.
- la vitesse d'une réaction élémentaire ne dépend
jamais de la concentration d'un produit.
- l'ordre partiel par rapport à un réactif A est égal au
coefficient st
 chiométrique ( entier ) de A.
chiométrique ( entier ) de A.
- Une réaction élémentaire n'a pas d'intermédiaire
stable.
- Sa constante de vitesse satisfait la loi d'Arrhénius:
où
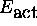 est une quantité d'énergie appellée
énergie d'activation de la réaction.
Le facteur pré-exponentiel A est souvent considéré
constant. En fait il dépend de T, mais plus faiblement que le facteur
exponentiel lui-même, (voir démonstration au chapitre 2, section 2.3.4).
est une quantité d'énergie appellée
énergie d'activation de la réaction.
Le facteur pré-exponentiel A est souvent considéré
constant. En fait il dépend de T, mais plus faiblement que le facteur
exponentiel lui-même, (voir démonstration au chapitre 2, section 2.3.4).
- les ordres partiels d'une réaction complexe ne sont pas relié
s aux coefficients st
 chiométriques.
chiométriques.
- Sa loi de vitesse est purement phénoménologique. Elle ne r éflète pas directement un évènement moléculaire isolé .