



Next: Critique
Up: Théorie simple des
Previous: Libre parcours moyen
Une application de la théorie simple des collisions est une première modélisation, phénoménologiquement simpliste certe mais très abordable, de la dynamique moléculaire d'une réaction élémentaire du second ordre.
En vue des limitations discutées à la fin de la section précédente, cette théorie des collisions ne peut être utilisée, dans le cadre des collisions réactives, que pour le comptage des collisions pré-réactionnelles, si on peut ainsi décomposer un évènement de collision réactive.
Pour obtenir ensuite le nombre de collisions qui, par unité de temps et par seconde, conduisent à une réaction, on doit ajouter des critères de sélection des collisions dont la fréquence  est donnée par eq.(2.17). Ces critères sont de deux types
est donnée par eq.(2.17). Ces critères sont de deux types
- critère énergétique: Il s'énonce
Toute collision d'énergie 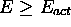 peut être réactive.
peut être réactive.
Or, à partir de la loi de Maxwell-Boltzmann, on peut montrer que la fraction de collisions ayant une énergie de collision 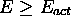 est
est
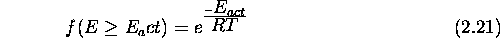
- critère géométrique ou stérique: On admet que seules les collisions au cours desquelles les deux molécules présentent certaines orientations favorables peuvent conduire à une réaction. On tient compte de ce genre de critère, plus vague que le premier, en introduisant un facteur stérique P défini par
P = fraction de collisions présentant une orientation favorable pour la réaction
Combinant eq.(2.17) et eq.(2.21) et introduisant un facteur stérique P, on obtient

On verra au chapitre 5 que ceci représente la loi de vitesse de la réaction bimoléculaire

avec constante de vitesse k exprimée en termes des paramètres de la théorie simple de collisions

On écrit souvent ceci sous la forme de la loi d'Arrhénius

où A est dit facteur pré-exponentielle, et est donné par
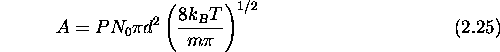
On définit aussi une constante de vitesse maximale  par
par
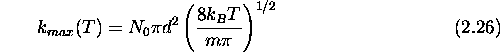
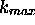 serait la constante de vitesse de la réaction si aucune sélection, ni la sélection énergétique, ni la sélection stérique, des collisions bimoléculaires n'avait été nécessaire.
serait la constante de vitesse de la réaction si aucune sélection, ni la sélection énergétique, ni la sélection stérique, des collisions bimoléculaires n'avait été nécessaire.




Next: Critique
Up: Théorie simple des
Previous: Libre parcours moyen
Cours WWW Cinetique Chimique
Wed Jan 8 16:28:09 EST 2003
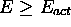 peut être réactive.
peut être réactive.
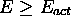 est
est
 est donnée par eq.(2.17). Ces critères sont de deux types
est donnée par eq.(2.17). Ces critères sont de deux types
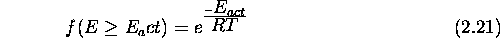




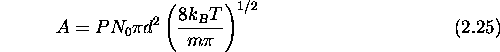
 par
par
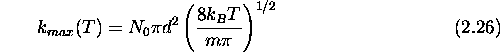
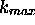 serait la constante de vitesse de la réaction si aucune sélection, ni la sélection énergétique, ni la sélection stérique, des collisions bimoléculaires n'avait été nécessaire.
serait la constante de vitesse de la réaction si aucune sélection, ni la sélection énergétique, ni la sélection stérique, des collisions bimoléculaires n'avait été nécessaire.