L'atome d'hydrogène: modèle ondulatoire — Exercices et problèmes
3.1
Calculer la quantité de mouvement d'un photon de longueur d'onde égale à 500 nm.
1.325×10-27 kg.m.s-1
3.2
En diffraction électronique, on peut ajuster la longueur d'onde des électrons en changeant leur vitesse. Quelle vitesse doit-on leur donner pour que leur longueur d'onde soit 1nm?
Réponse:
727 km.s-1
3.3
Le butadiène CH
2=CH-CH=CH
2 est une molécule possédant 4 électrons π délocalisés. Montrer qu'un modèle de la molécule où ces électrons se comportent comme des
particules dans une boite de longueur 5.8 Å permet d'expliquer que la longueur d'onde la plus grande du spectre d'absorption du butadiène dans l'UV se trouve à 217 nm (il faut noter que chaque fonction d'onde ne peut décrire les propriétés de plus de 2 électrons).
Solution détaillée
3.4
On considère un électron confiné sur une boite unidimensionnelle de longueur L=2Å.
- Calculer les deux plus basses énergies permises.
- calculer la longueur d'onde de la radiation permettant d'exciter l'électron de son niveau fondamental au premier niveau excité.
- Calculer la probabilité que l'électron dans l'état fondamental se trouve à ±0.5Å du centre de la boite.
- Que devient cette probabilité lorsque l'électron se trouve dans le premier niveau excité.
Solution détaillée
3.5
Un électron est confiné dans une boite unidimensionnelle de longueur L = 10 Å.
- Calculer les quatre plus grandes longueurs d'onde du spectre de raies de ce système. Représenter schématiquement sur un diagramme d'énergie les transitions correspondant à ces raies.
- Tracer (à l'aide d'un logiciel ou sur un papier millimétré) la densité de probabilité de l'électron en fonction de sa position dans la boite, dans l'état fondamental et dans le premier état excité.
- Calculer la probabilité de présence de l'électron à ±1Å du centre de la boite, dans l'état fondamental et dans le premier état excité.
- Les résultats numériques obtenus dans la question c) sont-ils en accord avec les tracés de la question b).
Solution détaillée
3.6
Les orbitales de l'atome d'hydrogène sont décrites par trois nombres quantiques: n, l et m.
- Si n = 2 et m = -1, quelles sont toutes les valeurs possibles de l ?
- Si n = 2 et m = 0, quelles sont toutes les valeurs possibles de l ?
- Si l = 2 et n = 3, quelles sont toutes les valeurs possibles de m ?
- Si l = 0 et n = 5, quelles sont toutes les valeurs possibles de m ?
- Si m = 1 et l = 1, quelles sont toutes les valeurs possibles de n ?
Solution détaillée
3.7
Parmi les ensembles de nombres quantiques suivants, indiquer, en expliquant pourquoi, lesquels ne sont pas permis pour l'atome d'hydrogène:
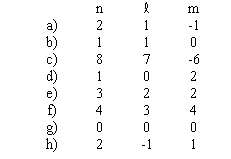
Solution détaillée